
[corner-ad id=1]La chimica, come la matematica, può essere considerata una lingua universale comune a tutto il globo.
La poesia descrive la conoscenza e le emozioni con armonia. Quando si inizia a parlare di chimica si deve immaginare un lungo percorso che conduce e spiega sia la diversità e la molteplicità dei vari elementi chimici, sia la definizione e creazioni di composti chimici.
Il big bang, il collasso delle stelle, le supernove sono tutte manifestazioni che hanno causato la creazione di tutti gli elementi conosciuti e di cui sono composti tutti gli esseri viventi.
La parte più piccola della materia viene considerata l’atomo.
Per l’atomo il primo modello è quello planetario. Nell’immaginare la configurazione elettronica esterna al nucleo si possono utilizzare delle semplificazioni ammesse dalla comunità scientifica, per cui vengono usati dei modelli che calzano molto bene e facilitano la comprensione di realtà molto più articolate.
Allora si prefigurano degli elettroni che ruotano attorno al nucleo come la luna e i satelliti artificiali ruotano attorno alla terra. In particolare l’atomo si ritiene costituito da una parte intima chiamata nucleo, che a suo volta è costituita da protoni, con massa e carica positiva, e da neutroni con massa ma senza carica. Attorno al nucleo ruotano uno o più elettroni con carica negativa e considerati senza massa, percorrendo precisi orbitali (s, p, d, f). A livello microscopico la distanza è notevole tra il nucleo e la configurazione elettronica esterna, per cui si parla di spazio vuoto. Come la gravità tiene legati la terra e la luna, così gli elettroni negativi sono fortemente collegati al nucleo positivo in modo elettrostatico.
Si ribadisce che questo modello presenta dei forti difetti, ad esempio la fisica classica ci insegna che quando un corpuscolo carico come l’elettrone è dotato di un moto uniforme e non rettilineo esso deve irraggiare energia elettromagnetica (onde radio). L’errore risiede nel fatto che si cerca di applicare alla struttura dell’atomo, un mondo microscopico, le leggi fisiche, meccaniche ed elettromagnetiche proprie del mondo macroscopico, come i pianeti.
Solo dopo il 1915 grazie all’ingegno di alcuni scienziati come Plank, Einstein, Bohr, De Broglie, Heisemberg, ecc., ci si rese conto che all’infinitamente piccolo vanno applicate leggi particolari: la teoria quantica; tale teoria si basa su un ben preciso postulato: l’energia di un sistema microscopico, di qualsiasi tipo essa sia, non corrisponde ad un insieme continuo di valori, ma può assumere solo alcuni e ben determinati valori; cioè si dice che è quantizzata.
Tornando alla configurazione elettronica, questo significa che l’elettrone che possiede un orbita, nella teoria planetaria semplificata, può assumere solo precise e determinate posizioni energie di posizione: il moto dell’elettrone è quantizzato (N. Bohr). Questo modello quantizzato soddisfaceva anche altri principi della fisica classica in quanto l’emissione di energia elettromagnetica poteva avvenire solo quando l’elettrone effettua un salto quantico, da un orbita ad energia più elevata in una a più bassa energia.
L’affinamento del modello proseguì nel corso degli anni e in seguito a dibattiti e colpi di ingegni si arrivò al 1925 quando si superò l’idea di un elettrone come una piccolissima pallina o corpuscolo con massa ben localizzata: l’ipotesi rivoluzionaria della meccanica ondulatoria propone un elettrone non ben localizzato, bensì ben diffuso come un onda.
Questa teoria proposta da Heisemberg introduce il concetto di probabilità: in un mondo microscopico non si può conoscere con esattezza la traiettoria di un elettrone per localizzarlo, ma si può conoscere la probabilità di avere una frazione di tale elettrone in un certo istante, in un determinato punto dello spazio atomico.
Nel XVIII secolo, scoprendo i vari elementi, si conoscevano sempre meglio le varie caratteristiche, e furono osservate come esistevano forti analogie fra alcuni gruppi di elementi, sia da un punto di vista fisico, sia chimico.
Vi furono vari tentativi finché il chimico russo Dimitri Mendeleev propose nel 1869 una tabella che rappresenta le correlazioni periodiche delle proprietà dei vari elementi noti fino allora. Tale costruzione si basò sull’ipotesi che le proprietà periodiche fossero in relazione con i pesi atomici dei vari elementi.
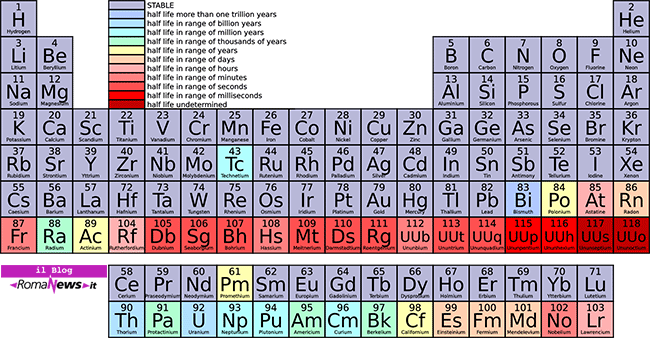
Allora gli elementi che stavano sulla stessa colonna possedevano proprietà simili ma la cosa interessante è rappresentata dal fatto che, siccome alcune caselle rimanevano vuote, Mendeleev intuì che corrispondessero ad elementi sconosciuti ancora da scoprire: ne predisse con incredibile precisione le proprietà fisiche e chimiche. Va ricordato come nel 1869 solo i due terzi degli elementi erano stati caratterizzati con sicurezza.
Gli elementi raggruppati in ordine crescente di peso atomico mostrano delle proprietà che si ripetono ad intervalli regolari (funzione periodica).
Bisogna osservare con ammirazione come sia stato applicato agli albori il metodo scientifico: da un numero enorme di osservazioni riuscì a definire una regolarità che approdò alla legge periodica.
Allora le colonne verticali si chiamano gruppi o famiglie chimiche, le righe orizzontali si chiamano periodi: un periodo corrisponde al completamento di un guscio elettronico: nelle prime due colonne sono presenti elementi in cui si riempie l’orbitale s più esterno; le ultime 6 colonne corrispondono agli elementi gli orbitali p più esterni.
Gli elementi sono degli atomi che possiedono specifiche caratteristiche: un modello attendibile ma semplificato ci consente in modo utilitaristico di capire il comportamento di queste particelle infinitesimali.


Lascia un commento